这部分介绍的概念较为丰富,笔者学起来感觉比较吃力。目前稍作总结,欢迎讨论。如果大家已经掌握基本概念,可以直接看最后的概念关系总结。
关键词:外电势、内电势、表面电势、电化学势
欢迎提出任何宝贵的改错改进意见,谢谢!
笔者联系方式:mozheyang@outlook.com
物理电势
外电势(Outer Potential/ Volta Potential)
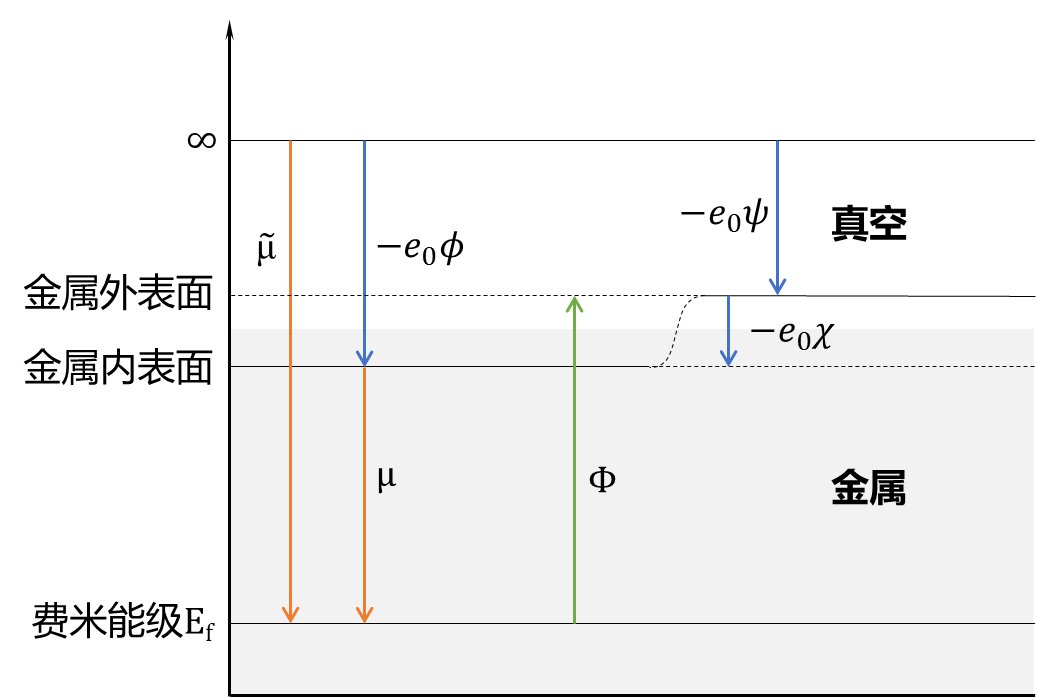
外电势$\phi$是将一个电子从无穷远处移动到金属电极表面附近(通常距离表面约1μm)所需要的能量。
内电势(Inner Potential/ Galvani Potential)
内电势$\psi$将一个电子从无穷远处移动到金属电极内部所需要的能量。该过程需要穿过金属表面,因此表面电势而可以定义为内电势与外电势之差,即
表面电势(Surface Potential)
表面电势无法测量,从而导致内电势无法测量。其产生原因复杂,目前尚未有定论。目前认可的主要原因有:
①金属电极表面的吸附导致了表面弛豫或重构,从而表面能量会发生降低。
②金属电极表面电子溢出至溶液中,形成界面偶极。带电粒子穿越界面偶极需要对其做功,从而产生了表面电势。
电化学势
在等温等压、表面积不变(界面能不改变)和其他组分不变的条件下,当系统发生变化时,系统的Gibbs自由能变化量应等于组分i的化学功和静电功之和。化学功即化学势,静电功可表示为$zF \phi$,那么可以将二者之和定义为一个新的势,称为电化学势。其表达式如下:
界面电势差
金属-金属界面电势差(接触电势)
根据定义,费米能量与电化学势绝对值相等,符号相反。
不同类型金属接触后,二者会各自形成内电势以求达到二者费米能量的相等,也即电化学势的相等。令$\alpha和\beta$两种金属电化学势相等,有
即
由上式可知,若我们可以测出两种金属的化学势之差,我们便可以达到内电势之差。很遗憾,我们不能测出两种金属的化学势之差。于是,根据内电势、外电势和表面电势之间的关系,我们对电化学势表达式做改变如下
于是有
其中,$\Phi_{\alpha}$和$\Phi_{\beta}$即为我们所定义的功函数(work function)。从上式可知,若我们已知$\alpha和\beta$两种金属的功函数之差,我们便可以估计出二者外电势之差。
溶液-溶液界面电势差(液接电势)
无外加电场情况下,离子总是从活度高的区域向活度低的区域扩散。有外加电场情况下,该趋势与电迁移过程叠加。
金属-溶液界面电势差
在电化学系统中,非理想极化电极会与溶液中反应物种发生电子交换。若该种电子交换达到平衡,则反应物和产物的电化学势代数和相等,即
将上式展开为化学势和静电功,可以改写为
那么可以得到下列等式
我们可以将$\phi = \left( \phi^{M}-\phi^{S} \right) - \frac{\mu_{e}^{M}}{F}$定义为绝对电极电势,从而得到氧化还原电极的Nernst方程
其中,
而更普遍地,
总结 | 各概念之间的相互关系