这部分内容已经在何师兄的LectureNote中进行了详细叙述,笔者在此只做核心思想的简单归纳。本文的主要参考材料也正是何师兄的LectureNote[1]。
关于过渡态理论,有部分难以理解的地方,笔者特地做了一个较为详细的背景补充和补充解释,详见PDF文件。
欢迎提出任何宝贵的改错改进意见,谢谢!
笔者联系方式:mozheyang@outlook.com
写在前面
宏观模型(Macroscopic Model)主要通过热力学方法,对化学反应中的动力学过程进行讨论。其中过渡态理论是对Arrhenius公式所进行的完善,Butler-Volmer公式是利用以上规律对电流电压关系的求解,而Marcus-Hush理论是对以上所考虑的电子传递过程的更复杂化(溶剂化)的考虑。接下来,笔者会对四个模型的核心思想进行简要介绍。
模型讨论
Arrhenius公式
热激活过程几乎均适用的经验公式。该公式的缺点在于不能解释指前因子的物理含义。
在一定电化学系统中,指前因子的对数与活化能成线性关系。该现象被称为补偿效应(Compensation Effect)。
过渡态理论(TST, Transition State Theory)
通过合理假设,赋予指前系数以物理意义。
难点:配分函数(统计热力学概念)的理解,在文首所标识的PDF文件中做了详细阐述,感兴趣的读者可前去查看。
Butler-Volmer公式
电化学反应动力学中,最早提出,并且仍然应用最广泛的公式。主要思想为增加电势$\eta$前后,自由能曲线会发生变化,如文献[2]中图示。
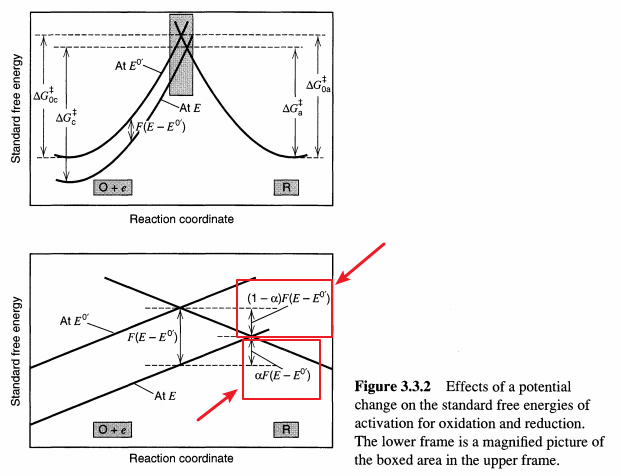
图中,$\eta = E-E_{0}$. 增加电势$\eta$前
增加电势$\eta$后
Marcus-Hush理论
考虑离子溶剂化实体的振动对反应活化能的影响。
始态离子处于氧化态,其能量为
终态离子处于还原态,其能量为
令重组能$\lambda=\frac{1}{2}g^{2}$,溶剂化坐标$q=\frac{E_{e}}{2\lambda}$,则可得到Marcus-Hush理论关于活化能的简单表达形式
有关于Marcus-Hush理论的复杂表达形式可查看Marcus的原始文献。
参考材料
[1] 何政达. LectureNote of Electrochemistry. 2017.
[2] Bard A J, Faulkner L R, Bard A, et al. Electrochemical Methods: Fundamentals and Applications, 2nd edn[M]. Wiley, 2001.